Laboratorien
Labor für
Leitung
Prof. Dr. rer. nat. Thomas Göen
- Telefon: +49 9131 85-26121
- E-Mail: thomas.goeen@fau.de
Gaschromatographische Analysensysteme (GC)
Agilent 7000 Series Triple Quadrupole GC-MS/MS; (Agilent Technologies)
Hochauflösendes Gaschromatographie-Tandem-Massenspektrometrie System
ausgestattet mit EI- und PCI/NCI-Ionenquelle
Agilent GC-MSD (7890A GC + 5975C MS) (Agilent Technologies)
Hochauflösendes Gaschromatographie-Massenspektrometrie System
ausgestattet mit EI- und PCI/NCI-Ionenquelle & CombiPAL Autosampler (CTC Analytics)
Headspace GC-MS: Agilent GC-MSD (7890A GC + 5975C MS) (Agilent Technologies)
Hochauflösendes Gaschromatographie-Massenspektrometrie System
ausgestattet mit Perkin Elmer Turbo Matrix 40 Trap Headspace Autosampler
HP GCD (G1800A) (Hewlett-Packard)
Hochauflösendes Gaschromatographie-Massenspektrometrie System
HP 5890 Series II (MS 5989A) (Hewlett-Packard)
Hochauflösendes Gaschromatographie-Massenspektrometrie System
ausgestattet mit EI- und CI-Ionenquelle
HP 5890 Series II Plus (MS 5989A) (Hewlett-Packard)
Hochauflösendes Gaschromatographie-Massenspektrometrie System
Varian GC 3400 FID/ECD (Varian Inc.)
Hochauflösendes Gaschromatographie System mit Flammenionisations- & Elektroneneinfang-Detektor
Varian GC 3400 FID (Varian Inc.)
Hochauflösendes Gaschromatographie System mit Flammenionisations-Detektor
Varian GC 3300 Headspace-FID/ECD (Varian Inc.)
Hochauflösendes Gaschromatographie System mit Flammenionisations- & Elektroneneinfang-Detektor
ausgestattet mit einem Headspace Probengeber Typ HSS 3950 (DANI SpA)
Flüssigkeitschromatographische Analysensysteme (LC)
HPLC-MS/MS System; (Agilent Technologies, Applied Biosystems)
Hochauflösende Flüssigkeitschromatographie-Anlage HP 1100 mit quarternärer Pumpe P1 (G 1311A), Autosampler (G 1313A) und Vakuumentgaser (G 1322A)
gekoppelt mit Tandem-Massenspektrometer Sciex API 2000 mit softwaregesteuertem 10-Wege-Ventil und Elektrospray-Ionisierung (ESI)-Interface
VWR LaChrom Elite HPLC-FLD; (VWR)
Hochauflösende Flüssigkeitschromatographie-Anlage mit Fluoreszenz-Detektor (FLD) L-2485
Merck LaChrom HPLC-FLD; (Merck)
Hochauflösende Flüssigkeitschromatographie-Anlage mit Fluoreszenz-Detektor (FLD) L-7480
2x Merck LaChrom HPLC-DAD; (Merck)
Hochauflösende Flüssigkeitschromatographie-Anlage mit Dioden-Array-Detektor (DAD) L-7450A
Merck LaChrom HPLC-FLD/UV; (Merck)
Hochauflösende Flüssigkeitschromatographie-Anlage mit Fluoreszenz-Detektor (FLD) L-7480 & UV-Detektor L7400
UPLC-MS/MS System; (Waters Corporation)
Ultrahochauflösende Flüssigkeitschromatographie-Anlage ACQUITY UPLC H-Class (zweidimensionaler Betrieb möglich) mit quarternärer Pumpe (ACQ H-Class QSM Plus), binärer Pumpe (ACQ Binary SOL MGR), Autosampler (ACQ H-Class FTN-H Plus) und Säulenofen (ACQ CM-A) gekoppelt mit einem Tandem Massenspektrometer Xevo-TQ-XS mit Elektrospray-Ionisierung (ESI)-Interface
Spurenanalytik in humanem Probenmaterial (Urin, Blut, Serum, Gewebe)
Acrylamid / Acrylnitril
Aminoalkohole / Kühlschmierstoffe
Aromatische Amine
Organophosphat-Flammschutzmittel (OPFSM)
Pflanzenschutz- und Schädlingsbekämpfungsmittel (PSM)
endokrine Disruptoren (Phthalate/Weichmacher, Bisphenol A, Isoflavone)
Polychlorierte Biphenyle (PCB)
Polyzyklische aromatische Kohlenwasserstoffe (PAK)
Perfluorierte Tenside (PFT)
Monoterpene
Aromaten
flüchtige organische Verbindungen (VOC)
Prof. Dr. rer. nat. Thomas Göen
- Telefon: +49 9131 85-26121
- E-Mail: thomas.goeen@fau.de
PD Dr. Elisabeth Eckert
- Telefon: +49 9131 85-26127
- E-Mail: elisabeth.eckert@fau.de
Irene Bayer
- Telefon: +49 9131 85-22365
- E-Mail: irene.bayer@fau.de
Annette Braun
- Telefon: +49 9131 85-22365
- E-Mail: annette.braun@fau.de
Es konnte kein Kontakteintrag mit der angegebenen ID 401 gefunden werden.
Dr. rer. nat. Kerstin Hof
- Telefon: +49 9131 85-26272
- E-Mail: kerstin.hof@fau.de
Es konnte kein Kontakteintrag mit der angegebenen ID 409 gefunden werden.
Johannes Müller
- Telefon: +49 9131 85-22365
- E-Mail: hannes.mueller@fau.de
Leitung
Prof. Dr. rer. nat. Thomas Göen
- Telefon: +49 9131 85-26121
- E-Mail: thomas.goeen@fau.de
Probenvorbereitung
Multiwave 3000™ (Anton Paar)
Mikrowellen-Aufschlussgerät zur Nassveraschung im geschlossenen System
instrumentelle Analysensysteme
ICP-MS Agilent 7500 cx™ (Agilent Technologies)
Induktiv gekoppeltes Plasma-Massenspektrometer mit dynamischer Reaktionszelle
HPLC Agilent 1200 Series™ (Agilent Technologies)
Hochleistungsflüssigkeitschromatographie System für die Kopplung mit der ICP-MS
Elementanalytik in humanem Probenmaterial (Urin, Blut, Serum, Gewebe)
Elementspeziesanalytik in humanem Probenmaterial
Hochleistungsflüssigkeitschromatographie gekoppelt mit der induktiv gekoppelten Plasma-Massenspektrometrie mit dynamischer Reaktionszelle (HPLC-DRC-ICP-MS)
Prof. Dr. rer. nat. Thomas Göen
- Telefon: +49 9131 85-26121
- E-Mail: thomas.goeen@fau.de
Irene Bayer
- Telefon: +49 9131 85-22365
- E-Mail: irene.bayer@fau.de
Moritz Schäfer
- Telefon: +49 9131 85-26149
- E-Mail: moritz.schaefer@fau.de
Karin Seitz
- Telefon: +49 9131 85-26124
- E-Mail: karin.seitz@g-equas.de
Barbara Verhoeven
- Telefon: +49 9131 85-26128
- E-Mail: barbara.verhoeven@fau.de
Leitung
PD Dr. med. Sonja Kilo
- Telefon: 030-51548-4343
- E-Mail: sonja.kilo@fau.de
Diffusionszellsystem
- Franzzellen, (Permegear Europe, SES GmbH Analysesysteme) ummantelte Diffusionszellen, (5 ml Kammervolumen, Expositionsfläche 9 mm Durchmesser)
- Wasserbad (MV-4; Julabo Labortechnik GmbH) zirkulierend, thermostatisch geregelt, temperiert die Franzzelle über die wassergefüllte Ummantelung
- Variomag Multipoint 15 (H+P Labortechnik GmbH) Magnetrührplatte, kontinuierliches durchmischen der Rezeptorlösung der Franzzelle
Mikrodialysesystem
- PHD 2000 Infusion (Harvard Apparatus, Holliston, USA)
- PHD 2000 Programmable (Harvard Apparatus, Holliston, USA)
Spritzenpumpen, (0,0001 µl/h bis 220,82 ml/min)
Hautzustands-Messung
- Iso-Tech LCR 819 (RS-Components GmbH)
LCR: Induktivität (L) Kapazität (C) Widerstand (R) elektrische Hautwiderstandsmessung
- MPA 5 (Courage + Khazaka electronic GmbH)
Tewameter Transepidermaler Wasserverlust
Corneometer Hautfeuchtigkeit
Sebumeter Sebum der Hautoberfläche - Chroma Meter CR-400 (Konica Minolta)
Reflexionsfarbmessungen und Farbdifferenzmessungen (Kolorimetrie, Messöffnung: 8 mm) Messung der Hautfärbung
Temperatur-Messung
- RDXL6SD Datenlogger für Temperaturen (Omega Engineering GmbH)
Miniaturtemperaturfühler (Omega Engineering GmbH) intradermale Temperaturmessung
GOF 500 Universalfühler, Typ K (-65…+500 °C) (Greisinger electronic) Oberflächentemperaturmessung – Kontakt
- Optris®LS Infrarot-Handthermometer (Optris GmbH) Oberflächentemperaturmessung – berührungslos
pH-Messung
- pH-Meter SevenCompactTM (Mettler-Toledo GmbH)
Microminiature pH-Elektrode IC 401 (Multi Channel Systems GmbH, a division of Harvard Bioscience, Inc.) intradermale pH-Messung
- Temperature compensation Type 30 K pH-Elektrode (VWR)
Dermatom
- TC-Motor 3000 (Nouvag® GmbH, Konstanz) Mikroprozessor gesteuertes Motorsystem (max. Motordrehzahl: 30.000 Upm)
Dermatom 25 (Schnittbreite 25 mm; Schnittdicke: 0,5-0,55 mm, 0,05 mm Schritte; max. Motordrehzahl: 8.000 Upm)
Homogenisator/Dispergierer
- Ultra-Turrax T8 (IKA®- Werke GmbH & Co. KG)
S 8 N- 8G (Durchmesser Stator: 8 mm)
Weitere Labor-Grundgeräteausstattung
Präzisions-Waage: Analysewaage XA105 DualRange (Mettler-Toledo GmbH)
Magnetrührer, Heizplatte, Vortexer, Kreisschüttler …..
1. Diffusionszell-Methode (nach Franz 1975)
Exzidierte Humanhaut zwischen Expositions- und Rezeptorkammer (mit physiologischer Lösung gefüllt eingespannt (siehe Abbildung 1). Die Rezeptorkammer wird temperiert und die Hauttemperatur i.d.R. auf 32°C erwärmt.
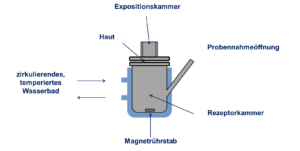
Abbildung1: Statischen Diffusionszelle nach Franz TJ (Percutaneus absorption. On the relevance of in vitro data. J Invest Dermatol 64:190-195).
Nach Applikation einer Substanz auf die Haut können verschiedene Parameter untersucht werden.
Penetration durch die Haut:
Zu definierten Zeitpunkten kann eine Probe aus der Rezeptorkammer entnommen werden und auf ihren Gehalt an applizierter Substanz analysiert werden.
Penetration in die Haut:
Die eingespannte Haut kann entnommen werden und auf ihren Gehalt an applizierter Substanz analysiert werden.
Hautschädigung:
Die eingespannte Haut kann entnommen werden und ihre Struktur histologisch untersucht werden.
Biochemische Reaktionen:
Zu definierten Zeitpunkten kann eine Probe aus der Rezeptorkammer entnommen werden und auf ihren Gehalt an bestimmten Markern (z.B. Interleukine) untersucht werden.
Metabolische Reaktionen:
Zu definierten Zeitpunkten kann eine Probe aus der Rezeptorkammer entnommen werden und auf ihren Gehalt an, aus der applizierten Substanz gebildete Metabolite untersucht werden
2. Mikrodialyse Technik
Ein Mikrodialyseschlauch wird in exzidierter Humanhaut eingelegt, mit einer Perfusionslösung durchspült und das Perfusat (fraktioniert) gesammelt (Abbildung 2). Substanzen können direkt auf die Haut appliziert werden (Abb. 2a) oder unter Umgehung des Stratum corneum zu exakt definierten Zeitpunkten über die Perfusionslösung direkt in die Haut eingebracht werden (Abb. 2b).
Je nach Fragestellung bietet sich diese Technik als Alternative zur Diffusionszelluntersuchung an.
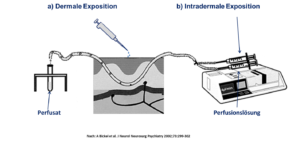
Abbildung 2: Mikrodialyse-Technik.
Nach Applikation einer Substanz auf die Haut können verschiedene Parameter untersucht werden.
Penetration in die Haut:
Das Perfusat kann über definierte Zeiträume gesammelt werden und auf den Gehalt an applizierter Substanz analysiert werden.
Hautschädigung:
Die Haut kann entnommen werden und ihre Struktur histologisch untersucht werden (Cave: mechanische Schädigung durch das Einlegen des Mikrodialyseschlauchs).
Biochemische Reaktionen:
Das Perfusat kann über definierte Zeiträume gesammelt werden und auf den Gehalt an bestimmten Markern (z.B. Interleukine) untersucht werden.
Metabolische Reaktionen:
Das Perfusat kann über definierte Zeiträume gesammelt werden und auf den Gehalt an, aus der applizierten Substanz gebildete Metabolite untersucht werden.
3. Weitere Untersuchungstechniken
Elektrische Hautwiderstandsmessung
Bestimmung des Transepidermaler Wasserverlust
Bestimmung der Hautfeuchtigkeit
Sebumbestimmung auf der Hautoberfläche
Messung der Hautfärbung
Intradermale pH Wertmessung
Intradermale Temperaturmessung
Leitung